
英文名称:
SPE-Ti-IMAC, 100%
中文名称:
固相萃取固定化亲和色谱微球
保存条件:
室温储存,保质期为五年。
适用范围:
本产品适用于对磷酸肽的鉴定和富集。
自备材料:
•样品:蛋白酶解液
注意:蛋白酶解液中不能含有干扰磷酸肽富集的物质,如 EDTA等络合剂、含磷酸根的缓冲盐!
•Loading buffer:80%ACN / 6%TFA水溶液
作用:将酶解液酸化,高浓度的 TFA-可以抑制酸性肽段的残留
•Wash buffer 1: 50%ACN / 6%TFA / 200 mM NaCl水溶液
作用:洗涤非特异性吸附的肽段,盐可以抑制非磷酸肽的残留。
•Wash buffer 2:30%ACN / 0.1%TFA水溶液
作用:洗涤残留的 Wash buffer1中的盐。
•Elution buffer:10%氨水溶液
•耗材:200 μL枪头、600 μl离心管、1.5 ml离心管、直径为 1 mm的筛板
•Tip柱准备:
(1)将 1 mm的筛板填入 200 μL枪头中,如图 1a-b所示,尽可能填的靠近枪头的底端。
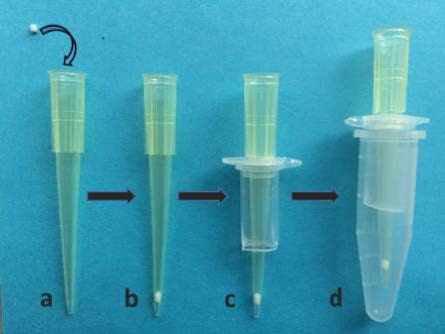
图 1
(2)如图 2所示,将 600 μL离心管剪开,在离心管盖中间打孔,使 200 μL枪头可以卡在图 1c所示位置;

如图 2
(3)如图 1d所示,1 mL离心管剪掉盖子作为套管,然后在 200 μL的枪头中加入适量已螯合 Ti4+的 SPE-Ti-IMAC材料,Tip柱制作完成,如图 3所示。

如图 3
注意事项:
本产品 SPE-Ti-IMAC材料未螯合 Ti4+,首先应先将 Ti4+螯合到材料上,然后再进行磷酸肽富集。
200 μl枪头一般建议最多装 10 mg SPE-Ti-IMAC材料,如果样品起始量较大,请按比例增加 SPE-Ti-IMAC材料使用量。当材料使用量为 100 mg以下,可以使用柱管体积为 1 ml的 SPE柱管及其对应筛板;当材料用量为 100-200 mg时,可使用柱管体积为 3 ml左右的 SPE柱管及其对应筛板。
实验步骤:
一、 SPE-Ti-IMAC材料的 Ti4+螯合
1、按照 SPE-Ti-IMAC材料:硫酸钛 Ti(SO4)2 = 1:50 (m/m),称取材料和硫酸钛。以称取 500 mg材料为例,将 25 g硫酸钛固体加入 50 mL平底离心管中,加入纯净水至 40 ml,超声溶解 (注意:硫酸钛在溶解过程中会放热,请缓慢加入)。向硫酸钛溶液中加入 SPE-Ti-IMAC材料,混匀,置于 Rolling Incubator上摇匀,室温过夜,请勿磁力搅拌。
注意:可按照实际制备情况酌情称取材料和硫酸钛,建议 SPE-Ti-IMAC材料不要低于 500mg。
2、次日,将步骤 1中的 SPE-Ti-IMAC材料静置至其完全沉到离心管底部,弃上清。
3、加入适量 0.1% TFA水溶液将 SPE-Ti-IMAC材料分散,混匀,静置至其完全沉到离心管底部,弃上清。
4、重复步骤 3,洗 5-6次左右,目的是尽量去除未螯合的 Ti4+。
5、加入 200 mM NaCl/0.1% TFA水溶液洗涤 SPE-Ti-IMAC材料 2次。
6、加入 0.1% TFA水溶液洗涤 2次,均匀转移至离心管中,可根据实验需求将 SPE-Ti-IMAC材料分散成不同的浓度(如 100 mg/ml或 10 mg/ml),于 4℃保存。
7、检测 SPE-Ti-IMAC材料是否成功螯合 Ti4+:取 100 μL最后一次洗涤的上清液,加入 100 μL 30% H2O2(市售双氧水原液)中,若溶液不变色,说明螯合后的 SPE-Ti-IMAC材料已经洗干净。若溶液变色,则继续洗涤。同时,可取少量 SPE-Ti-IMAC材料,加入 100 μL 30% H2O2中,若材料呈现明显黄色,说明 Ti4+螯合的 SPE-Ti-IMAC材料制备成功,可用于后续磷酸肽富集。
注意:上述 3-6步骤为 SPE-Ti-IMAC材料的洗涤,主要目的是洗涤未螯合的 Ti4+,请勿省略。
二、Tip (SPE)法富集磷酸化肽
1、蛋白酶解液与 Loading buffer按体积比 1:1均匀混合,SPE-Ti-IMAC:蛋白酶解液= 20:1-30:1(m/m)均匀混合。以下以 250 μg蛋白酶解液,SPE-Ti-IMAC材料:蛋白酶解液=20:1为例。
注意:Loading buffer一定要足量,保证 TFA终浓度≥3%;因 SPE-Ti-IMAC材料在 Ti4+螯合过程中会略有损失,建议根据实验具体情况,自行优化材料与样品的使用比例,以达到最优使用效果!
2、向 5 mg Ti4+螯合的 SPE-Ti-IMAC Tip柱中加入 200 μL 0.1%TFA,清洗材料。
3、250 μL蛋白酶解液(1 μg/μL)与 Loading buffer按体积比 1:1充分混合,加入到 Tip柱中进行富集,总时间控制在 20 min左右。
4、加入 200 μL Wash buffer 1洗涤,除去非特异性吸附,重复 1次,总时间控制在 10 min左右。
5、加入 200 μL Wash buffer 2洗涤 1次,除去上述步骤中残留的盐,时间控制在 5 min左右。
6、加入 200 μL Elution buffer洗脱 2次,合并洗脱液,即富集好的磷酸肽,总时间控制在 15 min左右。
7、洗脱的样品在冻干机中冻干,于-20℃保存,质谱分析时需用 1% FA复溶。
注意:Tip法富集磷酸化肽一般通过离心的方式进行,一是为了更好的控制液体从 Tip中的流出速度(以上述 5 mg SPE-Ti-IMAC Tip柱为例,上样和洗脱的过程离心力一般控制在 80-100 g,洗涤过程控制在 200 g),二是可以保证条件的一致,从而保证结果的重现性。上述 2-5步骤中的时间为离心时间。




